A sua apresentação ao publico através desta plataforma tem como objectivo dinamizar uma maior divulgação da natureza e da importância do composto amoniaco.
Tenho tambem como objectivo que outros bloggers que se interessem por esta temática contribuam com o seu comentário de forma a melhorar o conteudo deste trabalho.
O amoníaco é, à pressão atmosférica, um gás incolor, irritante,
inflamável, tóxico e de odor característico e sufocante, muito solúvel na água,
cuja molécula é constituída por um
átomo de nitrogénio (N) e três
átomos de hidrogénio (H) de
fórmula NH3.
Encontra-se
naturalmente presente no ar, dissolvido na água e está no solo sob determinadas
formas químicas.
Fig.1- Amoníaco.
O
amoníaco é utilizado no fabrico de sais, na transformação em ácido nítrico de
síntese, em cianetos ou em ureia e fosfato de amónio, assim como na produção de
precursores para fibras, plásticos, pesticidas e muitos outros compostos
orgânicos. O consumo mais importante do amoníaco é no sector de fertilizantes.
O amoníaco pode ser olhado como uma fonte indirecta de azoto e hidrogénio, em
que o transporte é infinitamente mais cómodo que o dos dois gases em separado,
pois é transportado na forma líquida.
A síntese industrial de amoníaco é feita pelo processo de Haber-Bosch,
descoberto devido à necessidade de disponibilizar uma maior quantidade de
alimentos com o aumento da população mundial, visto que o amoníaco possuía
azoto na sua constituição, elemento essencial ao desenvolvimento das plantas. O
amoníaco é principalmente usado na síntese de fertilizantes e de catalisadores,
na produção de ácido nítrico e como refrigerante. Também é utilizado como componente de vários produtos
de limpeza.
É obtido a partir do azoto atmosférico e do hidrogénio proveniente do gás
natural, segundo a seguinte equação química:
N2(g) + 3 H2(g)
2 NH3(g)
O
amoníaco é facilmente biodegradável. As plantas absorvem-no com muita
facilidade, sendo um nutriente muito importante como fornecedor de nitrogénio.
O amoníaco
produz-se industrialmente usando os gases azoto, N2, e hidrogénio,
H2, como matérias-primas. A reação de síntese do amoníaco é
representada pela equação química:
N2 (g) + 3H2 (g)
2NH3 (g)
A
reação de síntese é bastante incompleta, no caso de se realizar em condições de
pressão e temperatura normais. É através do processo Haber-Bosch, que se
consegue obter um maior rendimento (ainda que não muito satisfatório), através
de alterações que são feitas em determinadas condições que alteram o modo como
a reação de processa. Este é um dos mais importantes processos industriais da atualidade.
A descoberta do processo de produção de amoníaco, em 1909, permitiu a Haber receber o
prémio Nobel da Química em 1918, que veio revolucionar o desenvolvimento da indústria dos fertilizantes.
Haber
estudou as temperaturas e pressões necessárias para combinar os dois gases.
Sendo que, esta situação requeria condições difíceis de alcançar (Pressão = 200
Atm. Temperatura = 457 º C). Para isso foi necessário um catalisador onde se
misturou óxido de potássio, ferro e óxido de alumínio. Estava assim aberto o
caminho à produção de adubos por Haber; o que levou a um aumento da produção
agrícola a nível mundial.
Fig.6- Aparelho de Haber para a síntese do amoníaco.
Depressa vendeu a sua patente à BASF que delegou ao seu engenheiro Bosch a
tarefa de tornar este protótipo num processo à escala industrial. O processo de
1912 usa um catalisador de ferro, óxido de alumínio e óxido de potássio (como
promotor), o hidrogénio é produzido a partir do coque e, o azoto a partir da
destilação fracionada do ar, a 200 atm e à temperatura de 400ºC, ficou
conhecido como o método Haber-Bosch.
O engenheiro químico Carl
Bosh transformou o processo piloto de Haber num
processo industrial capaz de produzir milhares de toneladas de amoníaco por
ano.
É
frequente mencionar-se que o processo de Haber-Bosch salvou o mundo da fome ao
fabricar amoníaco para fertilizantes.
Em
1931, Bosch pela descoberta e desenvolvimento de técnicas de alta pressão para
a indústria química repartiu o prémio Nobel da Química.
Fig.7- Fritz Haber. Fig.8- Carl Bosh.
O processo de Haber relaciona o azoto e o hidrogénio através da seguinte
equação química:
N₂ (g) + 3H₂ (g)
Esta
reação de síntese do amoníaco é muito incompleta quando realizada em condições
de pressão e temperatura ambientes.
Este processo consiste em juntar N2 e H2 num
conversor a altas pressões (várias centenas de atmosferas), na presença de um
catalisador, e temperaturas na ordem das centenas de graus centígrados. Sob
estas condições, os dois gases reagem formando o amoníaco. A reação prossegue
sem que haja o consumo total do N2 e do H2. Chegando a um
equilíbrio em que os três componentes da mistura reacional estão presentes.
O equilíbrio químico é atingido tendo no início uma razão de 3:1 de N2
e H2
A proporção relativa de N2, H2 e NH3
presente no equilíbrio não depende da quantidade de catalisador presente. Mas
depende da quantidade relativa de N2 e H2 com a qual se
iniciou a reação. Se só amoníaco se colocar no conversor, nas condições
mencionadas, no equilíbrio persiste a mistura de N2, H2 e
NH3. No equilíbrio as concentrações de N2, H2
e NH3 são as mesmas quer se inicie a reação a partir dos reagentes (N2,
H2) ou se comece do produto puro (NH3) e tanto a reação
de formação do amoníaco, como a reação inversa em que azoto e hidrogénio
são formados, ocorrem à mesma velocidade.
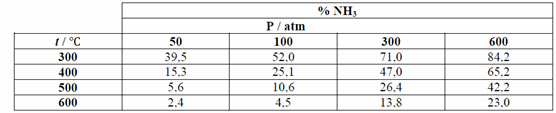
No desenvolvimento do processo de produção industrial do amoníaco a partir
de N2, H2, Haber procurou os fatores que aumentavam a
quantidade de amoníaco. A Figura 9, evidência o efeito da temperatura e da
pressão total na percentagem de amoníaco presente na mistura de equilíbrio com N2,
H2 e NH3 presentes. Cada um dos estados de equilíbrio foi obtido partindo-se de uma
mistura de N2, H2 de 3:1.
Fig.9- Quantidade de NH3 produzido em
função da pressão e da temperatura.
É evidente, pela análise do gráfico, que a
percentagem de amoníaco presente no equilíbrio diminui com o aumento de
temperatura e aumenta com o aumento de pressão. Estes efeitos são explicados em
termos do primeiro princípio de Henri-Louis Le Châtelier (1850-1936, químico
industrial francês).
A adição de H2 leva o sistema a
deslocar-se de modo a reduzir a concentração de H2 (contrariar a
perturbação importada ao sistema). Isto só ocorre porque o equilíbrio se
desloca no sentido de formar mais NH3. Ao mesmo tempo, a quantidade
de N2 diminui um pouco. A adição de mais NH3 ao sistema
em equilíbrio, leva a que este se ajuste para reduzir a concentração de NH3,
isto é, algum do amoníaco adicionado decompor-se-á.
Fig.10- Variação do estado de equilíbrio químico.
Na reação de Haber a remoção de NH3
da mistura em equilíbrio de N2, H2 e NH3 permite que a reação se desloque da esquerda
para a direita, de modo a formar mais NH3. Se o NH3 for
removido continuamente, a percentagem de NH3 formado pela reação de
Haber aumenta drasticamente. Na produção industrial do amoníaco o NH3
é removido por liquefação seletiva; o seu ponto de ebulição (-33ºC) é mais
elevado do que o do N2 (-196 ºC) e do H2 (-253ºC). O
amoníaco líquido é removido, e o azoto e o hidrogénio são reciclados para
formar mais NH3.
Se um sistema está em equilíbrio e o seu
volume é diminuído, isto é, a pressão total aumenta, o princípio de Le
Châtelier indica que o sistema responderá deslocando o equilíbrio no sentido da
diminuição de pressão, a temperatura constante. O sistema pode reduzir a sua
pressão por redução do número total das moléculas gasosas; menos moléculas de
gás menor pressão. Quando a mistura é comprimida, a composição do equilíbrio
tende a deslocar-se no sentido direto, porque assim diminui a pressão total no
sistema. Consequentemente, um aumento de pressão (diminuição de volume) leva à
formação de mais amoníaco, a reação desloca-se no sentido da formação do menor
número de moléculas.
A variação da pressão-volume não altera o
valor da constante de equilíbrio desde que a temperatura se mantenha constante.
A variação nas concentrações ou na pressão
total causa alteração no equilíbrio sem mudar o valor da constante de
equilíbrio.
Em contraste, a constante de equilíbrio
altera o seu valor quando a temperatura muda.
Quando a temperatura diminui, o equilíbrio
altera-se no sentido que corresponde à libertação de energia, de acordo com o
Principio de Le Châtelier. A reação de síntese do amoníaco, no sentido direto é
exotérmica. Um aumento da temperatura causa uma diminuição da formação de NH3
e aumenta a formação de N2, H2 (o equilíbrio desloca-se
no sentido inverso).
O valor da constante de equilíbrio altera-se
drasticamente com a variação de temperatura, sendo mais notado a temperaturas
mais baixas.
Para formar amoníaco a uma velocidade
razoável são necessárias temperaturas elevadas. Mas a altas temperaturas, a
constante de equilíbrio é menor, sendo a percentagem de conversão em amoníaco
menor. Para compensar, utilizam-se altas pressões, porque estas favorecem a
formação do amoníaco.
A tabela mostra as quantidades de amoníaco
formado em equilíbrio a diferentes pressões e temperaturas, que são removidas
por arrefecimento, com o azoto e hidrogénio residuais a serem recirculados.
Para ter um rendimento apreciável, tem de
se processar a pressão e temperatura elevadas (Pressão = 200 Atm.; Temperatura
= 457 º C) e na presença de um catalisador (ferro em pó com pequenas
quantidades de óxido de potássio e de óxido de alumínio).
Mesmo com estas condições, o rendimento é
muito baixo.
Ao desenvolver o processo de síntese do
amoníaco, Haber teve de lidar com um problema pertinente. A constante de
equilíbrio diminui rapidamente á medida que aumenta a temperatura. São
necessárias temperaturas suficientemente elevadas para se obter uma velocidade
razoável e satisfatória, no entanto, a quantidade de amoníaco formada é muito
pequena.
Haber compreendeu que tinha que comprimir
os gases e remover o amoníaco à medida que este era formado. A compressão
desloca a composição do equilíbrio para a formação do amoníaco. Removendo o amoníaco,
mais se propicia sua formação. Haber queria trabalhar a baixas temperaturas
porque a reação de síntese é exotérmica. Mas a baixas temperaturas, o azoto e o
hidrogénio combinam-se muito lentamente e por isso Haber teve de encontrar um
modo de aumentar a velocidade da reação.
A solução para este dilema consistiu em
desenvolver um catalisador que conduzia ao estabelecimento do equilíbrio
químico a velocidades razoáveis a temperaturas consideradas baixas, para que a
constante de equilíbrio se mantivesse em valores elevados. O desenvolvimento de
um catalisador ajustado tornou-se para Haber o seu maior esforço de pesquisa.
A percentagem do amoníaco aumenta quando
se aumenta a pressão mas os custos de construção da fábrica aumentam muito, por
isso um compromisso entre custo e produção deve ser encontrado.
Fig.11- Gráfico comparativo da percentagem molar
de amoníaco alterando a temperatura e a pressão.
Um problema similar acontece com a seleção
da temperatura: a baixas temperaturas a produção do amoníaco é favorecida (a
síntese é exotérmica) mas o equilíbrio é atingido muito lentamente para ser
rentável. Nas temperaturas e pressões usadas na prática, obtém-se de conversão
cerca de 15%. O amoníaco é condensado, e os gases que não reagiram são
recirculados.
A mistura N2 e H2 é
comprimida até cerca de 250 atm e passada sobre um catalisador de ferro
finamente dividido a cerca de 450 ºC O catalisador utilizado é constituído por
óxidos de ferro misturados com quantidades menores de outras substâncias (óxidos
de K, Ca, Al, Si e outros).
O papel do catalisador de ferro é garantir
um novo caminho para quebrar a forte ligação N≡N formando novas ligações para
os átomos de azoto. Os átomos de azoto estão assim livres para se combinarem
com os átomos de hidrogénio na superfície do catalisador, numa sucessão de
passos. O amoníaco rapidamente se separa do metal, regenerando a superfície
livre do ferro metálico. O caminho efetuado dos reagentes ao produto, para a
reação catalisada e não catalisada, em termos da energia do sistema, é
representado na figura:
Fig.12- Comparação entre a energia despendida durante a reação
catalisada e não catalisada.
A
linha vermelha indica o caminho da reação não catalisada e a linha azul indica
a introdução do catalisador. Torna-se claro que a transformação dos reagentes
no produto ocorre mais facilmente no caminho catalisado, daí a importância do
catalisador no processo de produção do amoníaco.
O
esquema em baixo traduz as etapas mais importantes da produção de amoníaco. Nele
podemos observar as substâncias envolvidas em cada fase da síntese, bem como os
locais onde estas ocorrem.
Fig.13- Etapas mais importantes na produção
do amoníaco, utilizando o processo de Haber-Bosch.
O azoto e o
hidrogénio entram num compressor onde são sujeitos a uma pressão elevada.
Posteriormente, passam para a câmara de reação ou conversor, onde se processa a
reação entre o azoto e o hidrogénio a temperaturas elevadas e na presença de um
catalisador.
N₂ (g) + 3 H₂ (g)
2 NH₃ (g)
Visto esta reação
não ser completa, ficam ainda por reagir grandes quantidades de azoto e de
hidrogénio.
Por esse
motivo, da câmara de reação sai uma mistura de amoníaco (NH₃) com azoto e hidrogénio. Esta mistura entra no
condensador, onde o amoníaco se liquefaz e é recolhido, uma
vez que o seu ponto de ebulição é mais elevado do que o do azoto e do
hidrogénio. Assim, reduzida que fica a concentração de amoníaco no sistema, o
processo pode continuar a realizar-se com maior extensão. Por fim, o azoto e o hidrogénio que não reagiram são
novamente introduzidos no conversor através de uma bomba de reciclagem.
Resumindo as condições para a produção industrial do amoníaco pelo processo
de Haber-Bosch são:
Para a síntese industrial do amoníaco é não só necessário ter em conta os
fatores que influenciam a reação química (cinética e equilíbrio), como também
fatores económicos e de segurança.
Outros processos de obtenção industrial do amoníaco
A seguir ao processo de Haber-Bosch, o método industrial mais importante
como fonte de amoníaco, consiste na recolha do subproduto da produção do coque,
por destilação destrutiva da hulha. O conteúdo em azoto da hulha betuminosa é
cerca de 1%, e quando esta hulha é aquecida na ausência do ar, o azoto é
separado como amoníaco, azoto livre, e outras substâncias nitrogenadas. O
amoníaco é separado por absorção em água, donde pode ser libertada por
tratamento com hidróxido de cálcio ou vapor. Este amoníaco é convertido em
sulfato de amónio para uso em fertilizantes ou é redissolvido em água para
formar uma solução de «hidróxido de amónio».
O terceiro método como fonte do amoníaco é o processo da cianamida. O
calcário é aquecido com excesso de coque num forno elétrico, o carboneto de
cálcio é o produto principal:
CaCO3 + 4 C → CaC2 + 3 CO
O carboneto de cálcio é depois aquecido numa corrente de azoto gasoso a
cerca de 1 000 ºC, e a cianamida cálcica é obtida:
CaC2 + N2 → CaCN2 + C
A cianamida cálcica é hidrolisada com vapor sobre pressão de acordo com a
equação:
CaCN2 + 3 H2O → CaCO3 + 2 NH3
A cianamida
cálcica é útil como fertilizante e como intermediário na produção de outros
compostos de azoto assim como fonte do amoníaco.







Sem comentários:
Enviar um comentário